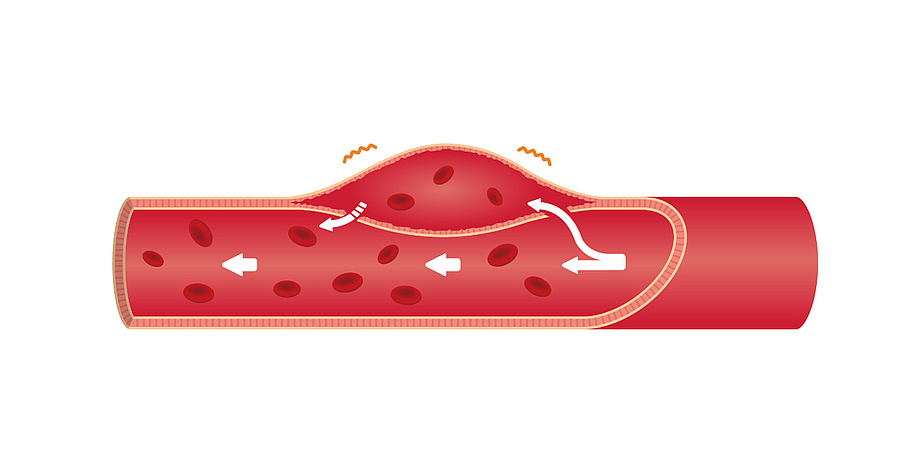
Mit heftigen Brustschmerzen, Atemnot und beängstigendem Vernichtungsgefühl wird Frau Z. (56) ins Krankenhaus eingeliefert. Was anfänglich nach einem Herzinfarkt aussieht, hat tatsächlich eine gänzlich andere Ursache: eine Aortendissektion (Aufspaltung der Wandschichten der Aorta) vom Typus B, was bedeutet: die absteigende Aorta ist betroffen. Die Hauptschlagader (lat. Aorta) ist die größte Arterie im menschlichen Körper. Sie leitet das Blut direkt aus der linken Herzkammer in den Blutkreislauf. Wenn hier etwas nicht Ordnung ist, herrscht höchste Alarmstufe. Frau Z. ist möglicherweise in akuter Lebensgefahr.
Ich, Sascha Ranftl (31), Physiker, möchte Frau Z. helfen. Als Teil eines interdisziplinären Teams im LEAD-Projekt „Mechanics, Modeling and Simulation of Aortic Dissection“ an der TU Graz arbeite ich an einer Computersimulationen der Aorta und numerischen Algorithmen zur Risikobewertung von Aortendissektionen. Unser Ziel: eine technische Hilfe für die Medizin.
Bluterguss in der Gefäßwand
Die Aortendissektion ist, vereinfacht gesagt, ein Bluterguss in der Gefäßwand der Aorta. Dieser Bluterguss entsteht aus einem Gewebedefekt in der Gefäßwand, welche wenige Millimeter dick ist. Vergleichbar mit einer Lasagne, besteht sie aus vielen dünnen, übereinanderliegenden Zellschichten. Ausgehend von kleinen Einrissen in den inneren Zellschichten der Gefäßwand-Innenseite (lat. Tunica Intima), drückt das Blut aus der Arterie in die Risse und dringt weiter in die Wand (lat. Tunica Media) ein. Druck und Kraftausübung durch die Blutströmung sorgen dafür, dass sich die Zellschichten voneinander lösen, die „Lasagnenblätter“ schälen sich ab. Der dabei entstehende Hohlraum, ein sogenanntes falsches Lumen, füllt sich mit Blut und dehnt sich immer weiter aus. Das falsche Lumen kann mehrere Zentimeter dick und bis zu 30 Zentimeter lang werden.
Eine akute Aortendissektion kann zu Organversagen führen, wenn sie beispielsweise die Blutversorgung der Nieren blockiert. Im schlimmsten Fall kann die Aorta durchreißen - eine sogenannte Aortenruptur. Beides erfordert eine sofortige Notoperation am offenen Herzen. Je nach Ausprägung enden bis zu 40 Prozent der Fälle tödlich. Eine chronische oder „stabile“ Aortendissektion hingegen zeigt keine derart dramatischen Komplikation.
Eine noch schwierige Entscheidung
Selbst mittels modernster Computertomographie ist keineswegs klar, ob eine „stabile“ Aortendissektion auch stabil bleibt, ob sie akut wird und wann sie akut wird. Ärzt*innen stehen hier vor einem schwierigen Problem, das über Leben oder Tod entscheidet. Kann Frau Z. mit Blutdruck- Senkern stabilisiert werden und für viele Jahre (beinahe) ohne Einschränkungen und Beschwerden weiterleben? Oder ist eine komplexe und risikoreiche Operation am geöffneten Brustkorb notwendig, um die Aorta durch einen künstlichen Schlauch auszutauschen? Medizinische Fachleute sind nach aktuellem Stand der Technik bei dieser Entscheidung hauptsächlich auf ihr Gespür und ihre Erfahrung angewiesen. Ob der Arzt von Frau Z. wohl ein gutes Gespür hat? Beide würden sich hier einen objektiveren Entscheidungsprozess wünschen.
Im Zentrum meiner Forschung steht die quantitative Bewertung der Unsicherheiten und Risiken bei Aortendissektionen. Dazu benutze ich Computersimulationen der Strömungs- und Biomechanik, die die Blutströmung und mechanischen Kräfte in den Gefäßen beschreiben. Zusätzlich benötige ich auch Methoden des Maschinellen Lernens und der Wahrscheinlichkeitstheorie, um schnelle Vorhersagen zu machen. So erlauben die Simulationen zwar durchaus zuverlässige und genaue Prognosen, diese benötigen aber einige Wochen Rechenzeit auf einem Supercomputer. Für Frau Z. ist es dann aber möglicherweise schon zu spät.
Dieses „Rechenzeitenproblem“ verschärft sich durch einen weiteren Aspekt: Für eine aussagekräftige Statistik brauchen wir mehrere zehn- bis hunderttausend Simulationen, von denen jede einzelne wochenlange Rechenzeit benötigt. Einige physikalisch-physiologische Parameter sind nämlich „in vivo“, das heißt am lebenden Patienten, nicht genau messbar. Zum Beispiel sind die Fließeigenschaften des Blutes oder die Gewebesteifigkeit der Aorta eines lebendigen Menschen schwer zu bestimmen.
Ein Trick spart Jahrhunderte
Wir müssen unsere Berechnungen also durchführen, ohne die Gewebe-Eigenschaften genau zu kennen. Unsere einzige Option ist, alle physikalisch plausiblen Werte dieser Parameter zu simulieren. Je nach Anzahl unbekannter Parameter sind das viele tausende Kombinationen von Parameterwerten, und die Rechenzeit geht in die Jahrhunderte.
Um trotz Rechenzeitenproblem zu einem Ergebnis zu kommen, bedarf es eines Tricks. Dazu entwickelte ich in meiner Doktorarbeit eine Künstliche Intelligenz (sog. Gauss-Prozess), die aus einer Handvoll Beispielsimulationen die Quintessenz der simulierten Strömungs- und Biomechanik extrahiert und erlernt. Der Lernprozess ist durchaus aufwendig, danach kann die Künstliche Intelligenz aber für unbekannte Parameterwerte näherungsweise neue Simulationen vorhersagen. Und zwar in Sekundenbruchteilen statt in Wochen oder Monaten. Rechenzeitenproblem gelöst.
So können die mechanischen Kräfte, die die Aortendissektion vorantreiben, zum Zeitpunkt der Diagnose abgeschätzt und verstanden werden, also direkt, wenn es medizinisch dringlich und kritisch ist und nicht erst Wochen später.
Die Brücke zwischen Simulation und Realität
Und wie lässt sich aus den vielen Simulationen das Risiko berechnen? Glücklicherweise haben theoretische PhysikerInnen im vergangenen Jahrhundert die Wahrscheinlichkeitstheorie weiterentwickelt. Mit Hilfe der Wahrscheinlichkeitstheorie konnte ich all diese physikalisch-physiologischen Informationen und Daten zusammentragen und eine quantitative Schätzung von Risiko und Unsicherheit berechnen. So erst schlagen wir die Brücke zwischen Computersimulation und Realität.
Anhand einer großen Anzahl an Simulationen berechnete ich einen Mittelwert und eine Schwankungsbreite - also eine Unsicherheit - für die mechanische Spannung. Ein Gewebe reißt (lat. Ruptur), sobald diese mechanische Spannung einen kritischen Grenzwert überschreitet. Zusätzlich lässt sich auch die Wahrscheinlichkeit dafür berechnen, dass die mechanische Spannung über diesen kritischen Grenzwert „drüber schwankt“. Je mehr die mechanische Spannung schwankt, desto wahrscheinlicher wird der Grenzwert überschritten.
Analyse lediglich eine Entscheidungsgrundlage
Ein Beispiel: Die mechanische Spannung allein durch den systolischen Strömungsdruck in der Aorta beträgt typischerweise einige Zehntel Millibar (mbar). Eine mittlere mechanische Spannung mit Schwankungsbreite wäre 0,70 mbar plus/minus 0,01 mbar. In diesem Fall ist die Wahrscheinlichkeit sehr gering, dass die mechanische Spannung größer als ein Grenzwert von 0,8 mbar wird. Hätten wir aber - bei gleichem Mittelwert - eine größere Schwankungsbreite von 0,7 plus/minus 0,2 mbar, wäre das Risiko viel größer, die Grenze von 0,8 mbar zu überschreiten. Eine Wahrscheinlichkeit von 0,1% für eine baldige Grenzwertüberschreitung und folglich eine Aortenruptur OHNE chirurgischen Eingriff hat medizinisch eine andere Bedeutung, als wenn diese Zahl bei 10 oder gar bei 50 Prozent läge. Die angezeigte Therapiewahl wäre jeweils völlig unterschiedlich.
Frau Z. hat Glück. Ihr Risiko ist bei 0,1 %, die mechanische Spannung schwankt im akzeptablen Rahmen. Die Operation bleibt ihr erspart. Vorerst.
Weder die theoretische Physik noch die Herzgefäßchirurgie kann allerdings sagen, wo die persönliche Grenze für das erträgliche Risiko liegt. Am Ende liegen diese Entscheidungen in den Händen der Betroffenen und Ärzt*innen, aber sie haben mit den Simulationen und der Unsicherheitsanalyse eine quantitative, technische Entscheidungsgrundlage.
Dieses Forschungsthema ist im Field of Expertise „Human & Biotechnology“ verankert, einem von fünf strategischen Schwerpunktfeldern der TU Graz.
Mehr Forschungsnews finden Sie auf Planet research. Monatliche Updates aus der Welt der Wissenschaft an der TU Graz erhalten Sie über den Forschungsnewsletter TU Graz research monthly.