Gutes braunes Fett im Kampf gegen Übergewicht
Fettzellen sind nicht gleich Fettzellen: Wir besitzen sowohl weiße als auch braune Fettzellen, die in unserem Körper unterschiedliche Aufgaben wahrnehmen. Während weiße Fettzellen aus der Nahrung aufgenommene Fette speichern und bei übermäßiger Kalorienaufnahme ständig anwachsen, sind braune Fettzellen gute "Verbrenner". Denn sie besitzen eine große Anzahl an Mitochondrien, die die Fettzellen braun erscheinen lassen. Diese Zellkraftwerke dienen Zellen unter anderem zur Energiegewinnung. In braunen Fettzellen sind sie auch jener Ort, wo ein bestimmtes Entkoppler-Protein (Uncoupling Protein-1, UCP-1) synthetisiert wird. Dieses Protein veranlasst, dass die u.a. aus der Spaltung von Fetten produzierte Energie unmittelbar in Wärmeenergie umgesetzt wird, anstatt sie – wie bei weißen Fettzellen – einzulagern.
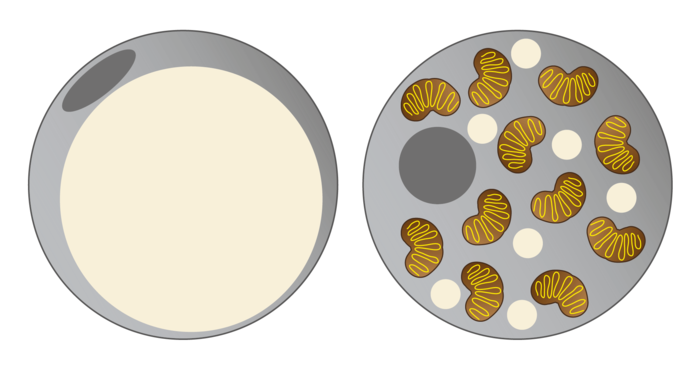
In einer weißen Fettzelle (links) füllt der Lipidtropfen, in dem Fett gespeichert wird, fast die gesamte Zelle aus. Braune Fettzellen (rechts) besitzen mehrere Lipidtröpfchen, die weniger Fett speichern, und gleichzeitig eine hohe Dichte an Mitochondrien, die für die hohe Stoffwechselaktivität dieser Zellen verantwortlich sind.
Braunes Fettgewebe stellt bei Neugeborenen sicher, dass die Körpertemperatur trotz großer Körperoberfläche und geringer Muskelmasse konstant bleibt. Bis vor kurzem wurde angenommen, dass sich die braunen Fettgewebedepots zurückentwickeln und in Erwachsenen nicht mehr vorhanden sind. Doch 2009 konnten Forschende beweisen, dass auch Erwachsene in der Nackenregion braune Fettzellen besitzen. Seitdem wird intensiv daran geforscht, wie effektiv diese sind. Denn bei stark übergewichtigen Personen ist dieses braune Fettzellendepot nur wenig aktiv oder fehlt gänzlich.
Braune Fettzellen unter der molekularen Lupe
Am Institut für Biochemie der TU Graz widmet sich die Forschungsgruppe um Juliane Bogner-Strauss diesem Thema auf molekularer Ebene. In einem vom österreichischen Wissenschaftsfonds FWF geförderten Projekt möchten die Forschenden herausfinden, welche zugrundeliegenden Schaltkreise und Pfade die Entwicklung von braunen Fettzellen und ihre Aktivität steuern. Bereits im Jahr 2013 konnten sie in den Mitochondrien von braunen Fettzellen ein Protein – N-acetyltransferase 8-like (NAT8L) – identifizieren, das die Aktivität von braunen Fettzellen beeinflusst.
N-Acetyl-Aspartat: Molekül mit Doppelmission
NAT8L ist jenes Enzym, das die Produktion von einer bestimmten Aminosäure, N-Acetyl-Aspartat (NAA), in den Mitochondrien ermöglicht. "NAA war bis vor kurzem als ein essentielles Zwischenprodukt für die Lipid- und Cholesterinsynthese im Gehirn bekannt. Wir konnten zeigen, dass NAA nicht nur im Gehirn eine wichtige Rolle spielt, sondern auch die Aktivität von braunen Fettzellen steuert", erläutert Juliane Bogner-Strauss. In einer kürzlich publizierten Studie konnte das Team um Bogner-Strauss nun zeigen, dass nicht nur die Produktion, sondern vor allem der Abbau von NAA für die Erhöhung der Aktivität in braunen Fettzellen verantwortlich ist. Denn wenn NAA in braunen Fettzellen akkumuliert und nicht abgebaut werden kann, hatte das überraschenderweise eine negative Wirkung: "Wir haben durch unsere in vitro-Versuche festgestellt, dass mit steigender Konzentration von NAA in braunen Fettzellen ihre Stoffwechselaktivität heruntergeschraubt wird. Die eigentliche Schlüsselrolle nimmt ein Enzym ein, das den Abbau von NAA im Zytosol der Fettzelle in Gang bringt", so Juliane Bogner-Strauss.
Wenn dieses Enzym namens Aspartoacylase blockiert wird, steht der Zelle weniger zytosolisches Acetyl-CoA zur Verfügung, daher nimmt auch die Histon-Acetylierung im Zellkern der Fettzelle ab. Histone sind fest um die DNA "gewickelte" Proteine. Durch die Acetylierung lockern sie sich, und die DNA kann daraufhin von der Transkriptionsmaschinerie abgeschrieben werden. Ist die Histon-Acetylierung heruntergeschraubt, so werden weniger Gene transkribiert und entsprechend weniger Proteine wie das Entkoppler-Protein UCP-1, das für die Aktivität der braunen Fettzellen ausschlaggebend ist, synthetisiert.
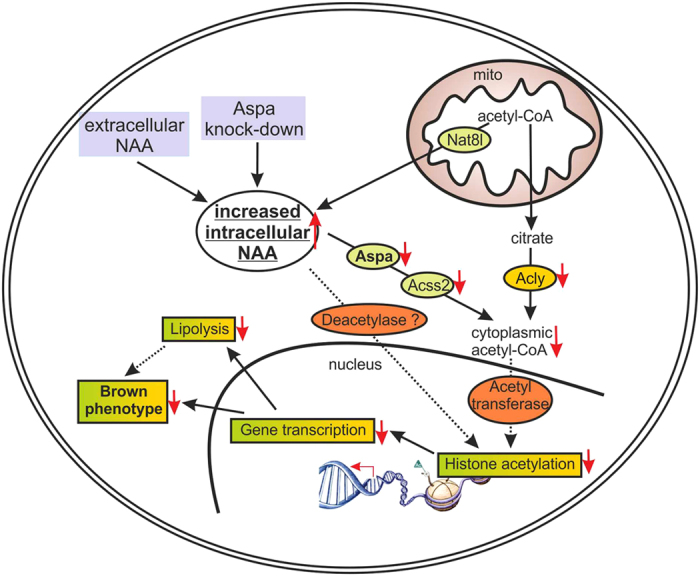
Schema des NAA-Signalweges in einer braunen Fettzelle: Wenn die Enzymaktivität von Aspa im Zytosol einer braunen Fettzelle reduziert wird, erhöht sich die Konzentration an NAA im Inneren der Zelle (Zytosol) und dadurch steht der Zelle weniger Acetyl-CoA zur Verfügung. Durch die daraufhin ausgelöste Signalkette werden weniger Proteine, die für die Stoffwechselaktivität der braunen Fettzellen ausschlaggebend sind, synthetisiert.
NAA-Signalweg als möglicher Therapie-Angriffspunkt
Die Studienergebnisse sind für die Adipositas- und Diabetesforschung besonders relevant, da bei Personen mit Adipositas und Typ-2-Diabetes veränderte NAA-Werte im Urin gemessen wurden. "Ein interessanter Aspekt ist hier vor allem, dass NAA in Lebensmitteln vorkommt, über die Nahrungsaufnahme auch in die Fettzellen gelangen kann und dadurch Signalwege beeinflussen könnte", erklärt Bogner-Strauss. In vivo Studien in Zusammenarbeit mit Kolleginnen und Kollegen am Max Planck-Institut für Immunbiologie und Epigenetik in Freiburg könnten diesbezüglich bald mehr Aufschluss geben. "Auf jeden Fall zeigen unsere derzeitigen Ergebnisse den NAA-Signalweg als ein mögliches Ziel auf, um therapeutische Interventionen für die Adipositas-Forschung zu entwickeln", so Bogner-Strauss abschließend.

Juliane Bogner-Strauss und ihr Team am Institut für Biochemie der TU Graz.
Kontakt
Juliane BOGNER-STRAUSS
Assoc.Prof. Mag.rer.nat. Dr.rer.nat.
Institut für Biochemie
Humboldtstrasse 46/3
8010 Graz
Tel.: +43 316 380 4970
juliane.bogner-strauss@tugraz.at
www.tugraz.at/projekte/cellism/