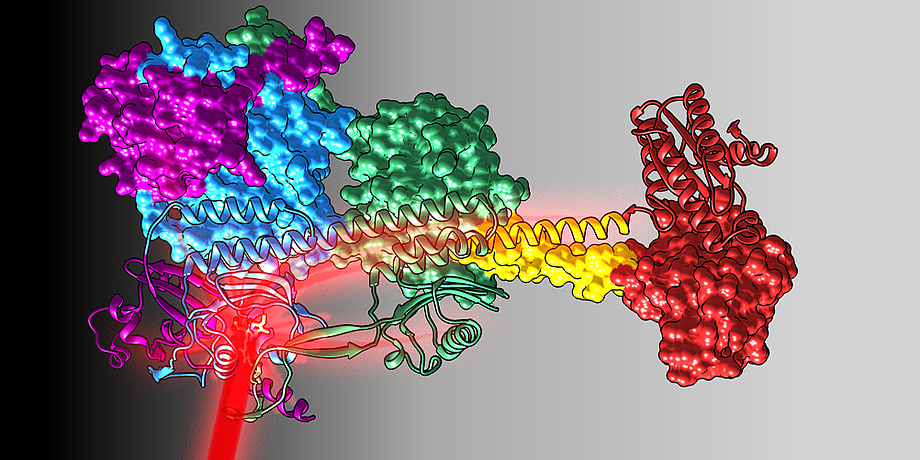
Genetisch modifizierte Zellen mittels Licht zu kontrollieren ist das Ziel der Optogenetik. Grazer Wissenschafterinnen und Wissenschafter rund um Andreas Winkler vom Institut für Biochemie der TU Graz setzen einen Meilenstein für die zukünftige Entwicklung neuartiger rotlichtregulierter optogenetischer Werkzeuge zur gezielten Zellstimulation: Erstmals konnten sie in der Volllängenstruktur eines Proteins molekulare Prinzipien der Sensor-Effektor-Koppelung beobachten und detaillierte Mechanismen der Signalübertragung über große Distanzen auf molekularer Ebene beschreiben. Die Forschungsergebnisse wurden nun im Open Access Journal Science Advances publiziert.
Eine Helix als Lichtschalter
Um zu überleben, müssen sich Zellen und Organismen effizient neuen Umweltbedingungen anpassen. Dafür sorgen modulare „Proteinbausteine“, die auf unterschiedlichste Weise miteinander wechselwirken und so zelluläre Netzwerke ermöglichen, die eine Anpassung an veränderte Umgebungen erlauben. Die Sensoren, also „Empfänger“ von äußeren Reizen wie etwa Licht, sind zum Teil direkt an spezifische Effektoren gekoppelt, um gezielt zelluläre Signalmoleküle je nach Bedarf zu aktivieren oder zu hemmen. In ihrer Arbeit präsentiert die Grazer Forschungsgruppe, der neben Forschenden der TU Graz auch Wissenschafter der Med Uni Graz angehören, nun molekulare Details eines rotlicht-empfindlichen Fotorezeptors, der an der Herstellung eines zentralen bakteriellen Botenstoffes beteiligt ist, und beschreibt erstmals die Struktur eines Volllängen-Fotorezeptors im Zusammenspiel mit seinem enzymatischen Effektor. Der Architektur und der Zusammensetzung des Verbindungsstückes, das Sensor und Effektor miteinander verknüpft, kommt dabei in der Lichtregulation besondere Bedeutung zu.
TU Graz-Biochemiker Andreas Winkler, Leiter der Forschungsgruppe: „Mithilfe der Kombination aus Röntgenstrukturanalyse und der Methode des Wasserstoff-Deuterium-Austauschs, bei dem strukturelle Dynamik und Konformationsänderungen analysiert werden können, gelang es uns, die funktionellen Eigenschaften dieses helikalen Koppelungselements besser zu verstehen. Wir konnten zeigen, dass es durch die Belichtung des Sensors mit Rotlicht zu einer rotationsähnlichen Veränderung der Doppelwendel im Verknüpfungsbereich kommt, was wiederum Auswirkungen auf die enzymatische Aktivität des angrenzenden Effektors hat.“ Damit konnten die Grazer Forschenden erstmals strukturelle Daten zu einem rotlichtregulierten Volllängensystem ermitteln und molekulare Mechanismen der Signalübertragung beschreiben.
Auf dem Weg zum rationalen Protein-Design
Die Forschung trägt dazu bei, die Modularität natürlich vorkommender Proteindomänen besser zu verstehen und neue optogenetische Werkzeuge entwickeln zu können. In der Natur finden sich vielfältige Kombinationen unterschiedlicher Sensormodule, etwa Rotlichtsensoren, Blaulichtsensoren oder pH-Sensoren mit teilweise identen, aber auch verschiedenen Effektoren. Daraus schließen die Forschenden, dass es molekulare Gemeinsamkeiten in der Signalweiterleitung gibt, und dass somit rationale und völlig willkürliche Kombinationen von Sensoren und Effektoren, die es so in der Natur nicht gibt, denkbar sind. Andreas Winkler: „Derzeit sind wir bei der Verwendung direkt regulierter enzymatischer Funktionalitäten großteils noch auf natürlich vorkommende Systeme limitiert. Langfristiges Ziel ist es, neue lichtregulierte Systeme zu generieren, welche die Beschränkungen der Natur überwinden und für unterschiedlichste Anwendungen etwa in der Optogenetik interessant sind.“
Dieses Forschungsprojekt ist im Field of Expertise „Human & Biotechnology“ verankert, einem von fünf strategischen Schwerpunktfeldern der TU Graz.